Gastbeitrag:
 Siebter Beitrag der Artikelreihe:
Siebter Beitrag der Artikelreihe:
Moderne Mykologie in der Dermatologie
von Herrn Prof. Hans-Jürgen Tietz, Leiter des Instituts für Pilzkrankheiten, Berlin
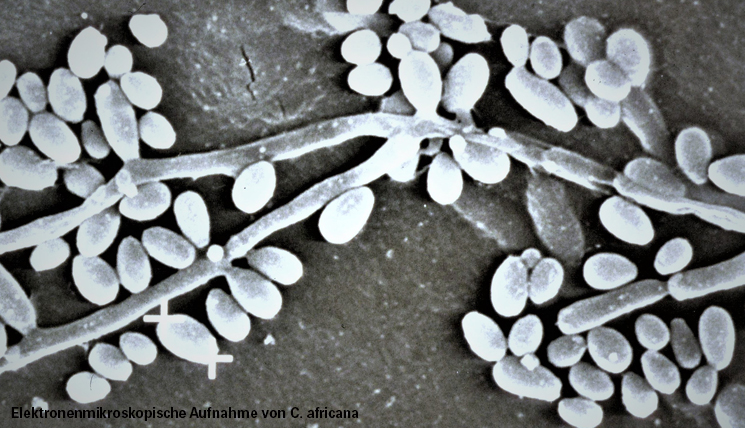
Die Entdeckung des Erregers war reiner Zufall. Während eines Lehrauftrages im Jahr 1989 an der Medizinischen Fakultät in Luanda, wo ich Medizinstudenten ausbilden sollte, dort selbst aber mehr lernte als lehrte, von Malaria, Cholera, Tetanus neonatorum und den daran erkrankten Menschen, fanden wir an der Frauenklinik bei Patientinnen mit akuter vaginaler Pilzinfektion einen Erreger, der in kein bisher bekanntes Identifikationssystem passte. Ihm fehlten die für C. albicans typischen Chlamydosporen. Ebenso kam sein biochemisches Muster in keinem Nachweissystem vor. Bis heute nicht.
Wie viele andere exotische Lebewesen, ist der Erreger vermutlich in geografischer Abgeschiedenheit auf Madagaskar entstanden, wo ihn später einer unserer Doktoranden bei Prostituierten fand. Von dort aus breitete er sich zuerst im südlichen Afrika aus. Heute trifft man ihn weltweit an, nach Migration und Tourismus zunehmend auch durch illegale Prostitution in Zeiten wie diesen.
Die Bildzeitung fand den Erreger damals auch interessant und titelte: „Tödlich wie AIDS? Charité entdeckt neuen Sex-Pilz“. Wir nannten den Erreger nach dem Ort seiner Entdeckung: Candida africana, obwohl es unter Pilzforschern durchaus üblich war, den neuen Keim nach dem jeweiligen Chef der Klinik zu benennen. Ein Beispiel ist Arthroderma gertleri. Der Geehrte war Prof. Johannes Gertler, Direktor der Charité-Hautklinik, Namensgeberin seine Mykologin, Frau Hannelore Ziegler-Böhme.
Inzwischen ist das Genom des Erregers entschlüsselt. Es handelt sich in der Tat um eine eigene Spezies. Denn ohne Chlamydosporen gehört der Keim weder zu C. albicans noch zu C. dubliniensis, ebenso wie eine Giraffe ohne Hals keine Giraffe ist. Trotzdem wird der Pilz immer noch gerne der Spezies C. albicans zugeordnet. Auch der Microarray von EUROIMMUN diagnostiziert ihn als C. albicans, was für eine gemeinsame Gensequenz im Testsystem spricht.

Man erkennt ihn in der PCR trotzdem an seinem besonderen, nicht so intensivem Signal (s. Abb. 1). Des Weiteren könnte man ihn mit Hilfe einer umfängliche biochemische Analyse identifizieren, was im Laboralltag jedoch sehr aufwendig ist und nur selten durchgeführt wird. Auch C. dubliniensis finden Labore in der Regel nicht, weil er aufgrund seiner Farbe auf Chromagar glatt als C. albicans „durchgeht“.
Das ist auch gut so. Denn alle genannten Spezies sind in der Pathogenität relativ gleich, gehören zur Gefahren-Klasse 2 der Pilzerreger und unterscheiden sich auch in der Therapie kaum. Der einzige klinisch relevante Unterschied zwischen C. africana und den beiden anderen Spezies besteht darin, dass dieser weit gereiste Pilzart keine Chlamydosporen bildet, eine solche Mykose dadurch nicht so hartnäckig ist und nur selten chronisch verläuft. Das klinische Bild bei C. africana ist meist akut. Eine Ursache dafür scheint die immunologische Fremde des Erregers zu sein. Zu vergleichen mit dem „Thailand-Pilz“, den Pocken in Lateinamerika oder der von dort im Gegenzug nach Europa eingeschleppten Syphilis, die anfangs sogar tödlich war.
Der Pilz aus Afrika, war eine wissenschaftliche Sternstunde für mich. Er ist unter der Bezeichnung „Candida africana Tietz et al., anamorph (ATCC® MYA-2669™)“ in den USA hinterlegt und wird bei Bedarf von der American Type Culture Collection weltweit für Studien und andere Zwecke bereitgestellt.
Verabschieden möchte mich heute mit einem Zitat des großen Pathologen und Politikers Rudolf Virchow, welches die Einführung der Gendiagnostik als Meilenstein in der Diagnostik der Mykosen nicht treffender beschreiben könnte:
„Auf dem Feld menschlicher Entdeckungen ist das Auffinden des Prinzips das Wesentliche, in dem sich daraus alle weiteren Vervollkommnungen nur als natürliche Fortbildungen ergeben“.
Man kann die PCR historisch gleichsetzen mit dem Gießen von Agar Agar in eine Petrischale durch Robert Koch, um darauf Erreger anzüchten zu können. Auch das war eine Revolution, ein Instrument, aus dem sich andere große Dinge ergaben, wie die Entdeckung des Erregers der Tuberkulose, sieben Hausnummern weiter von unserem heutigen kleinen PCR-Praxis-Labor entfernt, wo eine Gedenktafel daran erinnert.
In diesem Sinne viel Erfolg und auf bald
Ihr Hans-Jürgen Tietz
Die Artikel in der Rubrik “Gastbeiträge” geben die Meinung ihrer Autoren wieder. Die inhaltliche und rechtliche Verantwortung liegt allein bei den Autoren. EUROIMMUN übernimmt weder eine Garantie für die Richtigkeit und die Vollständigkeit der Angaben, noch für deren Aktualität.