Anstrengende Monate und unzählige Nachtschichten liegen hinter Prof. Rolf Hilgenfeld und seiner kleinen Arbeitsgruppe vom Institut für Biochemie an der Universität zu Lübeck. Ende Juli 2016 wurde ihre Publikation über die Kristallstruktur eines überlebenswichtigen Proteins des Zika-Virus im Fachjournal Science (Lei J et al., Science 2016, 353(6298):503-5) veröffentlicht – ein Projekt, an dem sie seit nicht mehr als 6 Monaten gearbeitet haben; nachdem sich das Zika-Virus in Latein Amerika ausbreitet und Infektionen schwangerer Frauen mit schweren kongenitalen Missbildungen des embryonalen Gehirns in Verbindungen gebracht werden.
Die Achillesferse des Zika-Virus
„Wir wussten, dass wir starke Konkurrenten haben, die auch an der Kristallstruktur der viralen NS2B-NS3 Protease arbeiten. Mehrere Arbeitsgruppen waren uns dicht auf den Fersen, die letzten Monate waren deshalb sehr anstrengend.“ Das Wissen über die dreidimensionale Struktur und Faltung des Proteins ist von so großer Bedeutung, da es die Grundlage für die Entwicklung von Protease-Hemmstoffen zur Behandlung infizierter Personen ist. Das Zika-Virus gehört wie das Dengue- und West-Nil-Virus zur Gattung der Flaviviren, die durch Stechmücken übertragen werden. Die NS2B-NS3 Proteasen dieser Viren werden zwingend für ihre Vermehrung benötigt, außerdem setzen sie Proteine der angeborenen Immunantwort des Wirtes außer Kraft. „Sie sind so etwas wie die Achillesferse der Viren“, erklärt Herr Prof. Hilgenfeld. Im Vergleich zu den Proteasen des Dengue- oder West-Nil-Virus ist die NS2B-NS3 des Zika-Virus auch noch hyperaktiv und hat eine deutlich höhere Affinität zu ihren Substraten. Diese werden von der Zika-Virus-Protease 20-mal effektiver umgesetzt als von den anderen Virus-Proteasen. „Das könnte natürlich bedeuten, dass sich das Zika-Virus viel schneller vermehrt, als beispielsweise das Dengue- oder West-Nil-Virus, und dass es die angeborene Immunantwort des Wirtes noch effizienter ausschaltet. Das weiß man aber alles noch nicht“, erläutert der Wissenschaftler.
Enzyme funktionieren nach dem Schlüssel-Schloss-Prinzip, d.h. ein spezifisches Substrat passt exakt in die sogenannte aktive Tasche des Enzyms, in der die katalytische Reaktion stattfindet. Je besser die dreidimensionalen Formen des Enzyms und des Substrats ineinander passen, desto effektiver ist die Umsetzung des Substrats. Die Entschlüsselung der Struktur des Enzyms sollte deshalb die Erklärung für die Hyperaktivität und einen Ansatz für die Entwicklung eines Hemmstoffes (Inhibitors) liefern, der das aktive Zentrum bindet und für das eigentliche Substrat blockiert. Das Enzym würde so inaktiviert und das Virus unschädlich gemacht.
Vom Enzym zum Kristall
Technisch ist es aber gar nicht so einfach, die Kristallstruktur eines Enzyms herauszufinden. In diesem Fall verändert die NS2B-NS3-Protease sogar ihre Konformation, wenn es ein Substrat oder einen Inhibitor gebunden hat (aktive Form). Um also die Struktur des aktiven Enzyms zu identifizieren, brauchten die Forscher einen Bindungspartner für das Protein. Unterstützung kam von Prof. Christian Klein und Dr. Christoph Nitsche von der Universität Heidelberg in Form eines Borsäure-Dipeptids. Borsäure ist ein bekannter Inhibitor für Proteasen. Für den Einsatz als Medikament ist sie jedoch in der Regel zu unspezifisch, da sie selbst körpereigene Enzyme des Menschen blockiert.

Um den Komplex aus Protease und Inhibitor zu kristallisieren, musste zunächst das Protein hergestellt und gereinigt werden. Anschließend wurden kleinste Mengen der Protein-Inhibitor-Lösung in eine 96-Well-Mikrotiterplatte pipettiert, in der die Kristalle herangezüchtet werden sollten. Da jedes Protein seine ganz eigenen Befindlichkeiten bei der Kristallisation an den Tag legt, können die Bedingungen mithilfe eines Roboters für jedes Näpfchen auf der Platte unterschiedlich eingestellt werden. „Mindestens 20 Parameter können die Kristallisation beeinflussen und müssen variiert und angepasst werden. Das ist schon auch ein kleines Glücksspiel“, so Prof. Hilgenfeld. Sind die optimalen Bedingungen gefunden, können sich nach ein oder zwei Tagen die ersten Kristalle zeigen.

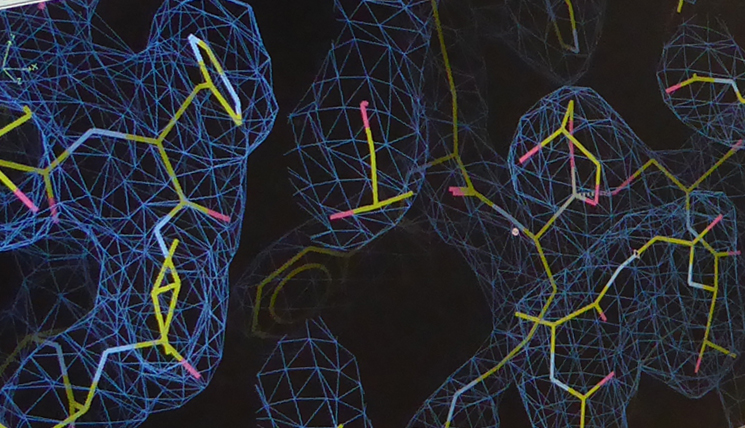
„Am 10. April waren wir so weit, mit den ersten Zika NS2B-NS3-Kristallen nach Hamburg zum Deutschen Elektronen-Synchrotron DESY zu fahren“. Dort analysierten seine Mitarbeiter Dr. Jian Lei und Linlin Zhang ihre Ausbeute in einem Röntgendiffraktometer. Das Diffraktometer misst die Beugung und Intensitäten der Röntgenstrahlen an dem Kristall. Das Ergebnis ist eine Elektronendichteverteilung, die zusammen mit der bekannten Aminosäuresequenz des Proteins in die dreidimensionale Kristallstruktur übersetzt werden kann. „Es steckt eine ziemlich elaborierte Mathematik dahinter. Dr. Guido Hansen hat an dieser Stelle entscheidend mitgeholfen, denn in dieser Phase hatte sich zunächst alles gegen uns verschworen“. Die Bildung seltener sogenannter Zwillingskristalle aus zwei verwachsenen Kristallgittern erschwerte die Arbeit maßgeblich.
Eine Besonderheit der Zika-Virus NS2B-NS3-Protease
Doch was steckt nun hinter der Hyperaktivität der Zika-Virus-Protease? In der sogenannten P2-Tasche des aktiven Zentrums des Enzyms findet sich im Vergleich zu den Proteasen des West-Nil- und Dengue-Virus eine andere Aminosäure, ein Aspartat. „Das Aspartat ist negativ geladen und wechselwirkt offenbar sehr viel stärker mit dem Substrat, das an dieser Stelle einen positiv geladenen Aminosäure-Rest aufweist. Dadurch ist die Bindung des Substrats viel stärker“. Der Aminosäureaustausch scheint also mitverantwortlich für die ungewöhnliche Effektivitätssteigerung des Enzyms. Und tatsächlich konnten die Wissenschaftler durch Mutation des einen Aspartat-Rests in eine ungeladene Aminosäure die Aktivität der Protease um die Hälfte reduzieren. „Trotzdem muss es noch weitere Faktoren geben, die zur Hyperaktivität des Enzyms beitragen, die wir bisher nicht entdeckt haben.“
Die Arbeitsgruppe von Prof. Hilgenfeld wird also weiter an der Protease forschen und sich auch an der Entwicklung eines spezifischen Hemmstoffes beteiligen, der irgendwann vielleicht zur Behandlung infizierter Personen eingesetzt werden kann.